Dickeya solani jest nowo wyodrębnionym gatunkiem Gram-ujemnych bakterii fitopatogennych wywołującym choroby ziemniaka, zwane „czarną nóżką” oraz mokrą zgnilizną, przyczyniające się do znacznych strat gospodarczych w uprawach ziemniaka. W swoim cyklu patogennym, bakteria ta występuje przede wszystkim w tkankach roślinnych, ale przez krótki okres czasu może przeżyć w glebie i wodzie, skąd może dokonywać infekcji nowych roślinnych gospodarzy. W obu typach środowisk, w roślinie i poza rośliną, D. solani jest narażona na szereg, często skrajnie różnych czynników stresowych. Jednym z efektów ekspozycji komórki bakteryjnej na niekorzystne warunki środowiskowe jest powstawanie nieprawidłowo zwiniętych białek. Ich obecność prowadzi do indukcji syntezy grupy białek ochronnych, określanych zbiorowo jako system kontroli jakości białek (SKJB). Ich rola polega na (1) zwijaniu białek w celu odzyskania natywnej struktury (białka opiekuńcze, czynniki wspomagające zwijanie) lub (2) degradowaniu nieodwracalnie uszkodzonych polipeptydów (proteazy). SKJB pełni także niezmiernie ważne funkcje w komórce w warunkach fizjologicznych. Między innymi jest niezbędny do prawidłowego zwijania nowopowstających polipeptydów i zapobiega nieprawidłowym oddziaływaniom między nimi, bierze udział w dojrzewaniu białek i składaniu dużych kompleksów białkowych. U bakterii chorobotwórczych SKJB pełni często kluczową rolę w patogenezie, m. in. poprzez udział w syntezie, dojrzewaniu i eksporcie czynników wirulencji oraz zabezpieczeniu bakterii przed skutkami działania mechanizmów obronnych gospodarza. W związku z tym brak funkcji składnika/ składników SKJB może prowadzić do obniżenia lub zaniku wirulencji bakterii. W przypadku patogenów roślin rola SKJB w odpowiedzi stresowej i patogenezie nie została dokładnie zbadana. Badania przeprowadzone w ramach niniejszego projektu są pierwszymi dla gatunku D. solani. Przeprowadziliśmy badania dla następujących elementów SKJB: głównych cytoplazmatycznych białek opiekuńczych DnaK, DnaJ i GroEL, dwóch głównych, zależnych od ATP proteaz cytoplazmatycznych, Lon i ClpP, cytoplazmatycznego małego białka szoku termicznego, IbpA, głównej periplazmatycznej oksydazy DsbA, odpowiedzialnej za wprowadzanie mostków disiarczkowych do pozacytoplazmatycznych białek, periplazmatycznej proteazy DegP oraz periplazmatycznego białka opiekuńczego FkpA.
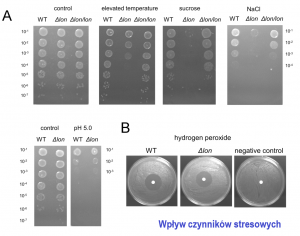
W pierwszym etapie przeprowadziliśmy kompleksowe badania, które umożliwiły scharakteryzowanie wrażliwości szczepu typowego D. solani IPO2222 na różnorodne czynniki stresogenne i ich kombinacje. Wykazaliśmy, że bakterie te są niezwykle podatne na niskie stężenia związku utleniającego, nadtlenku wodoru. Inne czynniki, np. podwyższona temperatura (37oC), kwasowe pH lub obecność związków osmotycznie czynnych, miały niewielki wpływ na wzrost D. solani. Natomiast niektóre kombinacje pewnych warunków znacząco obniżały zdolność bakterii do wzrostu. Wyniki powyższych badań zostały opisane w publikacji Przepióra i wsp. 2020.
W celu określenia udziału poszczególnych białek systemu SKJB w ochronie komórek przed skutkami stresu, zbadaliśmy poziom ekspresji kodujących je genów w komórkach traktowanych różnorodnymi czynnikami stresogennymi: podwyższoną temperaturą (37 i 40oC), związkami osmotycznie czynnymi (sacharoza i chlorek sodu), obniżonym pH (5,0), związkiem utleniającym (H2O2). Wykazaliśmy, że transkrypcja genów kodujących cytoplazmatyczne SKJB była stymulowana w większości warunków stresowych. Jedynie stres utleniający nie wpływał na poziom mRNA tych białek. Natomiast transkrypcja genów, kodujących periplazmatyczne SKJB była stymulowana tylko w niektórych warunkach. W warunkach stresu osmotycznego i kwasowego indukowany był gen degP, fkpA tylko w niskim pH. Poziom mRNA dsbA spadał podczas stresu osmotycznego i w wysokiej temperaturze (40oC).
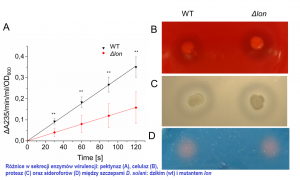
Stosując zmutowane szczepy D. solani, skonstruowane na potrzeby tego projektu, określiliśmy istotność niektórych cytoplazmatycznych (Lon, ClpP, IbpA) oraz periplazmatycznych (DsbA, DegP, FkpA) czynników kontroli jakości białek dla wzrostu D. solani w warunkach stresowych oraz patogeniczności tych bakterii. Najsilniejszy efekt mutacji został zaobserwowany w przypadku traktowania komórek związkami osmotycznie czynnymi – przede wszystkim chlorkiem sodu (NaCl) – znacznie obniżającymi zdolność do tworzenia pojedynczych kolonii na podłożu stałym u większości mutantów w porównaniu do bakterii niezmutowanych. Ponadto szczepy pozbawione cytoplazmatycznych proteaz, Lon i ClpP, były bardziej wrażliwe na traktowanie podwyższoną temperaturą (40oC). Natomiast, najbardziej wyraźny wpływ na wirulencję bakterii wywarła mutacja genu dsbA. Zmutowane bakterie nie były zdolne do wywołania objawów chorobowych. W przypadku D. solani pozbawionych proteaz Lon lub ClpP, zaobserwowaliśmy obniżoną patogeniczność zmutowanych szczepów wyrażającą się opóźnieniem wystąpienia objawów czarnej nóżki (lon) lub obniżoną liczbą roślin wykazujących objawy chorobowe (clpP).
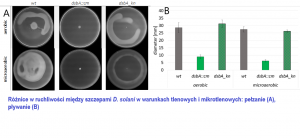
Ponieważ aktywność białek opiekuńczych i proteaz często jest potrzebna do prawidłowej i wydajnej produkcji czynników wirulencji, zbadaliśmy główne wyznaczniki zjadliwości u zmutowanych bakterii. Przede wszystkim zmierzyliśmy aktywność wydzielanych z komórki enzymów hydrolitycznych odpowiedzialnych za niszczenie ściany komórkowej roślin: pektynaz, celulaz i proteaz; a także określiliśmy zdolność bakterii do ruchu (pływanie i pełzanie) oraz wydzielanie sideroforów, związków niezbędnych do pobierania jonów żelaza ze środowiska zewnętrznego. Szczepy pozbawione funkcjonalnych genów dsbA, lon i clpP, charakteryzowały się znacząco obniżoną aktywnością pozakomórkowych pektynaz oraz mniejszą ruchliwością. Efekty te były szczególnie mocne w przypadku mutacji dsbA. Szczepy dsbA i clpP odznaczały się także niższą aktywnością celulaz. Natomiast bakterie pozbawione funkcjonalnych genów degP, fkpA oraz ibpA wytwarzały ww. wyznaczniki wirulencji na poziomie porównywalnym ze szczepem niezmutowanym.
W celu dokładniejszego wyjaśnienia przyczyn obniżonej wirulencji szczepów pozbawionych jednego z genów SKJB, dsbA, lon lub clpP, przeprowadziliśmy analizę proteomów zmutowanych komórek bakteryjnych. Okazało się, że każda z wprowadzonych mutacji wywołała znaczące zmiany w poziomach pewnych białek. Wiele z tych białek jest związanych z wirulencją lub odpowiedzią komórek na stres. We wszystkich zmutowanych bakteriach zaobserwowaliśmy zmiany poziomu białek związanych z ruchliwością komórek. Do tej grupy można zaliczyć flagellinę i białka związane z chemotaksją. Zawartość tych białek spadła ponad dwukrotnie w mutantach lon i dsbA, natomiast wzrosła (ponad dwukrotnie) w komórkach clpP. Ponieważ wszystkie zmutowane szczepy pozbawione tych genów wykazywały obniżoną ruchliwość, można wnioskować iż jakiekolwiek zaburzenie poziomu tej grupy białek negatywnie wpływa na zdolność bakterii do ruchu.
Komórki pozbawione Lon lub ClpP charakteryzowały się także zmienionymi proporcjami wśród białek odpowiedzialnych za utrzymanie homeostazy żelaza. Między innymi, zawartość białek zaangażowanych w syntezę sideroforów i białek magazynujących żelazo, była znacząco zmieniona w zmutowanych komórkach.
W mutantach wykryto także wzrost poziomu niektórych białek związanych ze stresem. Na przykład D. solani Δlon, traktowane szokiem termicznym zawierały ponad dwa razy więcej proteaz ClpP i HtpX, a także białka szoku osmotycznego OsmY i białek szoku zimna CspE i CspG. Podobny trend występował u mutanta clpP, gdzie zaobserwowano zwiększony poziom białek opiekuńczych ClpA i ClpX, proteazy HtpX, białek szoku osmotycznego OsmY i OsmE oraz białka szoku zimna CspG. Przypuszczalnie białka te mogą częściowo zastąpić funkcję Lon lub ClpP i umożliwić przeżycie zmutowanych komórek.
W bakteriach pozbawionych DsbA wzrastał poziom periplazmatycznej proteazy DegP, najprawdopodobniej odpowiedzialnej za degradację białek pozbawionych prawidłowych mostków S-S. Ponadto zaobserwowaliśmy podwyższoną zawartość oksydoreduktazy o własnościach białka opiekuńczego YbbN, podjednostki 1 oksydazy ubichinolu i składnika transportera cystyny FliY. Te zmiany były przypuszczalnie związane z łagodzeniem efektu braku aktywności DsbA.
Ponadto, w każdym ze zmutowanych szczepów zaobserwowaliśmy zmienioną zawartość szeregu białek odpowiedzialnych za przeprowadzanie podstawowych procesów życiowych komórki, takich jak transkrypcja, translacja i wiele głównych szlaków katabolicznych. Potwierdza to istotność systemu kontroli jakości białek w fizjologii komórki bakteryjnej.
W wyniku realizacji projektu zostały opublikowane następujące prace:
- Figaj Donata, Ambroziak Patrycja, Przepióra Tomasz, Skórko-Glonek Joanna: The role of proteases in the virulence of plant pathogenic bacteria, w: International Journal of Molecular Sciences, vol. 20, nr 3, 2019, ss. 1-30, DOI:10.3390/ijms20030672
- Przepióra Tomasz, Figaj Donata, Radzińska Marta, Apanowicz (Bukrejewska) Małgorzata, Sieradzka Małgorzata, Ambroziak Patrycja, Hugouvieux-Cotte-Pattat Nicole, Lojkowska Ewa, Skórko-Glonek Joanna: Effects of stressful physico-chemical factors on the fitness of the plant pathogenic bacterium Dickeya solani, w: European Journal of Plant Pathology, vol. 156, nr 2, 2020, ss. 519-535, DOI:10.1007/s10658-019-01902-z
- Figaj Donata, Czaplewska Paulina, Przepióra Tomasz, Ambroziak Patrycja, Potrykus Marta, Skórko-Glonek Joanna: Lon Protease Is Important for Growth under Stressful Conditions and Pathogenicity of the Phytopathogen, Bacterium Dickeya solani, w: International Journal of Molecular Sciences,vol. 21 (10), 3687, 2020, ss.1-30, DOI:10.3390/ijms21103687